LEUCEMIA MIELOIDE ACUTA – LMA
La leucemia è una neoplasia ematologica (tumore del sangue) che si sviluppa nel midollo osseo, nel sangue, nel sistema linfatico e in altri tessuti. Le leucemie sono comunemente distinte in acute e croniche, a seconda della velocità di progressione della malattia.
In generale, si parla di leucemia in presenza di alterazioni biologiche nelle cellule del sangue (globuli rossi, globuli bianchi e piastrine) che provocano una crescita e una proliferazione incontrollata delle cellule stesse. Il nome leucemia deriva dalla parola greca leucos = bianco proprio perché la malattia ha inizio nei globuli bianchi, le cellule incaricate di combattere le infezioni, che normalmente si riproducono secondo le necessità dell’organismo.
Nei pazienti affetti da leucemia, il midollo osseo produce un elevato numero di globuli bianchi anomali, che presentano mutazioni genetiche nel DNA e che non funzionano correttamente. Le cause di questa malattia non sono ancora note con esattezza, ma sembra che vi siano implicati sia fattori genetici sia ambientali.
La leucemia acuta origina dal midollo osseo, la sede in cui risiedono i progenitori (cellule immature) delle cellule del sangue e dove queste stesse cellule giungono a maturazione prima di “uscire” dal midollo osseo ed entrare nella circolazione sanguigna. Il termine “acuta” si riferisce alla rapida progressione della malattia.
Quando nel midollo osseo alcune di queste cellule immature vanno incontro a gravi alterazioni genetiche , cominciano a proliferare in maniera non controllata spesso ostacolando lo sviluppo delle cellule normali. La comparsa dei sintomi è molto precoce, fin dalle prime fasi di inizio della malattia, tanto che in alcuni casi può essere fatale (in poche settimane o qualche mese) se non si interviene in tempi brevi con le terapie del caso. Ciò nonostante, una buona parte di leucemie acute, soprattutto in soggetti giovani, può essere curata e guarita.
Le leucemie acute si dividono in due principali gruppi: la leucemia linfoblastica acuta (LLA) e la leucemia mieloide acuta (LMA).
La leucemia mieloide acuta colpisce con maggior frequenza gli adulti, e la sua incidenza cresce proporzionalmente con l’aumento dell’età.
Cause e fattori di rischio
La LMA è una malattia molto eterogenea, sia dal punto di vista clinico
che dal punto di vista del profilo biomolecolare. Come in molte altre
patologie non sono chiare le cause che originano una LMA e in questi
casi la malattia viene definita come LMA primaria.
Esistono però
dei fattori di rischio conosciuti, come l’esposizione a radiazioni
ionizzanti, agenti chimici tossici (es. fumo/benzene) o la presenza di
rari disordini genetici predisponenti (la sindrome di Down, la trisomia
dell’8, l’anemia di Fanconi, la sindrome di Bloom, l’atassia
teleangiectasia, la sindrome di Blackfan-Diamond, la sindrome di
Schwann, la sindrome di Li Fraumeni, la Neurofibromatosi 1, neutropenia
congenita severa anche chiamata sindrome di Kostmann), che se presenti
nella storia clinica del paziente fanno catalogare la malattia come LMA
secondaria.
È inoltre possibile che la malattia si sviluppi a
distanza di qualche anno da trattamenti chemioterapici o radioterapici, o
che sia il frutto dell’evoluzione di una precedente malattia
ematologica (Sindrome Mielodisplastica o Sindrome Mieloproliferativa).
Dal punto di vista molecolare la malattia è molto complessa e
caratterizzata da numerosi danni genetici che cooperano per lo sviluppo
della patologia. Nonostante tutto non è stato ancora identificato un
unico fattore come responsabile diretto della LMA.
Incidenza
La LMA ha un’incidenza stimata in circa 3-4 casi per 100.000 persone per anno ma, essendo una malattia tipica dell’età avanzata (età media 60 anni), può arrivare anche a circa 10 casi per 100.000 persone per anno nella popolazione al di sopra dei 65 anni (70% dei casi totali). La LMA si può presentare anche in età pediatrica, ma è decisiva la presenza di difetti genetici come, ad esempio, la sindrome di Down che aumenta il rischio di sviluppare la malattia di oltre 10 volte.
Sintomi
Questi sono i sintomi più comuni associati alla leucemia mieloide acuta:
- perdita di peso, stanchezza, febbre, sudorazioni notturne, inappetenza.
- mancanza di fiato, giramenti di testa, ipersensibilità al freddo, tachicardia
- aumentato rischio di sanguinamenti (epistassi, sanguinamento gengivale)
- aumentato rischio di infezioni
Trattamenti
Quasi la totalità dei pazienti con leucemia mieloide acuta devono essere sottoposti ad una terapia. Il piano terapeutico dipende da diversi fattori tra cui:
- età del paziente e le condizioni cliniche
- sottotipo di LMA
- presenza di malattia nel sistema nervoso centrale
- presenza di gravi infezioni alla diagnosi
- storia di precedente mielodisplasia o di precedenti terapie radio-chemioterapiche
Nella maggior parte dei casi il trattamento di scelta è rappresentato dalla chemioterapia secondo schemi inseriti nell’ambito di protocolli clinici condivisi da numerosi centri di Ematologia con esperienza nel campo della cura delle leucemie acute. La terapia si distingue in intensiva e conservativa.
Nei pazienti con età maggiore di 60-65 anni la chemioterapia intensiva ha spesso risultati inferiori rispetto ai più giovani. Questo è in relazione sia ad una maggiore frequenza di caratteristiche biologiche più aggressive rispetto alle leucemie dei soggetti più giovani, sia ad una maggiore fragilità clinica dei soggetti più anziani. nonostante ciò, sulla scorta dei risultati clinici fino ad oggi disponibili, la possibilità di porre l’indicazione per una chemioterapia intensiva va sempre presa in considerazione anche nei soggetti di età maggiore di 60-65 anni, previa un’attenta ed approfondita valutazione delle caratteristiche della leucemia e del paziente.
La chemioterapia intensiva molto spesso abbina almeno due chemioterapici allo scopo di ottenere la remissione completa di malattia. Quella conservativa ha l’obiettivo di attuare un controllo temporaneo della progressione della malattia senza cercare la remissione completa e prevede solitamente l’uso di un solo chemioterapico. La terapia della leucemia mieloide acuta prevede:
Chemioterapia
Ha lo scopo di eliminare le cellule leucemiche presenti nel midollo osseo e nel sangue così da permettere alle cellule immature normali residue del midollo di crescere e maturare per produrre cellule normali del sangue. Nella terapia intensiva i chemioterapici sono somministrati per via endovenosa, nella terapia conservativa possono essere somministrati anche per bocca. La chemioterapia intensiva viene somministrata in regime di ricovero, durante il quale il paziente viene sottoposto ad uno stretto monitoraggio dei valori dell’emocromo che raggiungono livelli molto bassi sia di globuli bianchi, sia di rossi e piastrine (fase di aplasia). La fase di aplasia può complicarsi con infezioni talora gravi che richiedono una complessa terapia antibiotica. La fase iniziale della chemioterapia intensiva viene denominata chemioterapia di induzione mentre le fasi successive chemioterapia di consolidamento e/o di mantenimento. Nella larga maggioranza dei protocolli clinici la chemioterapia di induzione si basa sull’associazione di 2 chemioterapici, un‘antraciclina (va ricordato che le antraciclinie furono scoperte in Italia) e la citarabina. La chemioterapia di consolidamento e/o di mantenimento possono avere modalità leggermente diverse in base ai diversi protocolli clinici. Al termine della chemioterapia di induzione ed in alcuni casi anche delle terapie di consolidamento/mantenimento, vengono ripetute alcune analisi sul midollo osseo e sul sangue periferico per definire la risposta al trattamento
Catetere venoso
Data la necessità di utilizzare molto frequente la via di somministrazione endovenosa, in particolare nella terapia intensiva, si posiziona di un catetere venoso centrale (CVC) in una vena del collo o sotto la clavicola. Il catetere è solitamente “tunnellizzato” ovvero una sua piccola porzione decorre sottocute prima di entrare nella vena succlavia, allo scopo di garantire una prolungata permanenza, una pronta accessibilità agli operatori e una più bassa incidenza di infezioni. Grazie al catetere venoso centrale vengono facilitati i prelievi di sangue, le trasfusioni di sangue e l’infusione di chemioterapici e antibiotici.
Trasfusioni
A seguito della chemioterapia, i valori dell’emocromo scendono spesso a livelli molto bassi prima che le cellule normali del sangue ricomincino a crescere. In questa fase è molto frequente che i pazienti debbano ricorrere a trasfusioni di globuli rossi e di piastrine. In Humanitas l’Unità Operativa di Ematologia ha maturato un’adeguata esperienza nella gestione delle complicanze della fase di aplasia post-chemioterapica nella cura delle leucemie acute.
Risposta al trattamento
Se la chemioterapia di induzione ha successo, il paziente ottiene la remissione completa della malattia. I valori dell’emocromo tornano nella norma (o quasi), il numero di cellule leucemiche (blasti) all’analisi morfologica del midollo osseo è <5% ed il paziente è solitamente in grado di lasciare l’ospedale. Le terapie di consolidamento/mantenimento hanno lo scopo di mantenere la remissione completa il più a lungo possibile, e fino al trapianto per coloro che possono essere avviati a tale procedura. La durata della chemioterapia e l’indicazione al trapianto dipendono dal tipo di leucemia, dalla sua categoria di rischio e dalle condizioni del paziente.
Trapianto di cellule staminali emopoietiche
Fino a 65 anni di età, i pazienti affetti da LMA possono essere candidati al trapianto di midollo. Il trapianto di midollo autologo (ovvero utilizzando le proprie cellule staminali emopoietiche) trova limitate indicazioni nella LMA.
Il trapianto allogenico (ovvero utilizzando le cellule staminali emopoietiche di un donatore sano) trova piena indicazione per tutte le leucemie acute ad alto rischio che raggiungono la remissione completa. La decisione di candidare un paziente con leucemia al trapianto autologo o allogenico è in relazione al tipo di leucemia, alla sua categoria di rischio, all’età del paziente, alle sue condizioni cliniche e si accompagna sempre ad un approfondito colloquio con i medici dell’Unità Trapianto su potenziali rischi e benefici. Le leucemie a buona prognosi non vengono mai candidate al trapianto, a meno che nel corso del trattamento si assista ad una ricaduta della malattia o la risposta venga giudicata insoddisfacente o incompleta.
Il trapianto allogenico resta l’unica arma in grado di offrire una speranza di guarigione anche in leucemie in fase avanzata o refrattarie ai trattamenti convenzionali. Humanitas ha maturato un’adeguata esperienza in campo trapiantologico, è accreditato per il trapianto da donatore non consanguineo ed offre la possibilità del trapianto da sorgenti alternative come cordone ombelicale e donatore familiare aploidentico o parzialmente compatibile.
.

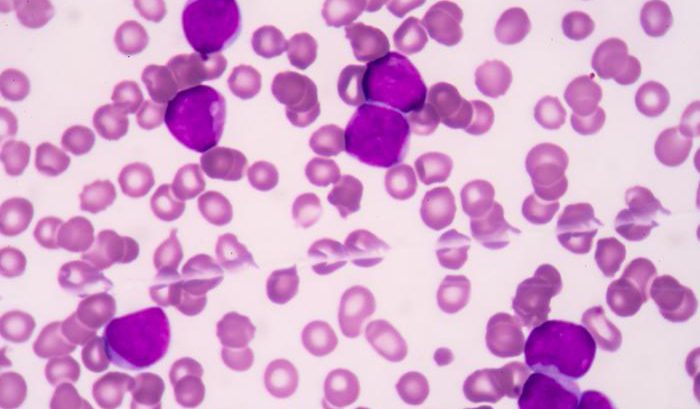
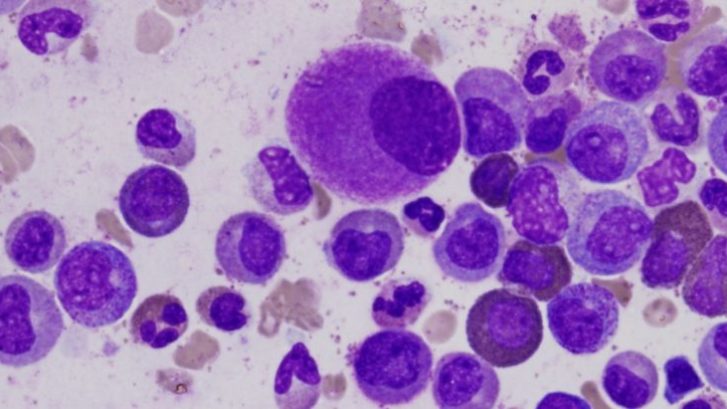
 Da circa un mese i pazienti con leucemia mieloide acuta ricoverati presso la ASST di Monza, in particolare all’ospedale San Gerardo, avranno un’arma in più per combattere la leucemia: un test in grado di individuare alterazioni geniche non identificabili con le normali metodiche.
Da circa un mese i pazienti con leucemia mieloide acuta ricoverati presso la ASST di Monza, in particolare all’ospedale San Gerardo, avranno un’arma in più per combattere la leucemia: un test in grado di individuare alterazioni geniche non identificabili con le normali metodiche.
